
- English
- Español
- Português
- русский
- Français
- 日本語
- Deutsch
- tiếng Việt
- Italiano
- Nederlands
- ภาษาไทย
- Polski
- 한국어
- Svenska
- magyar
- Malay
- বাংলা ভাষার
- Dansk
- Suomi
- हिन्दी
- Pilipino
- Türkçe
- Gaeilge
- العربية
- Indonesia
- Norsk
- تمل
- český
- ελληνικά
- український
- Javanese
- فارسی
- தமிழ்
- తెలుగు
- नेपाली
- Burmese
- български
- ລາວ
- Latine
- Қазақша
- Euskal
- Azərbaycan
- Slovenský jazyk
- Македонски
- Lietuvos
- Eesti Keel
- Română
- Slovenski
- मराठी
- Srpski језик
Zestaw do transportu wirusów firmy BABIO uzyskał zezwolenie FDA 510(k).
2025-10-30
Zestaw do transportu wirusów firmy BABIO uzyskał zezwolenie FDA 510(k).
Jinan, Chiny – październik 2025— BABIO Biotechnology, renomowany chiński producent medycznych odczynników diagnostycznych, z dumą ogłasza, że jegoZestaw do transportu wirusa (nieinaktywujący)otrzymałZezwolenie FDA 510(k) (K250205), oficjalnie potwierdzając jego zgodność z amerykańskimi standardami regulacyjnymi.
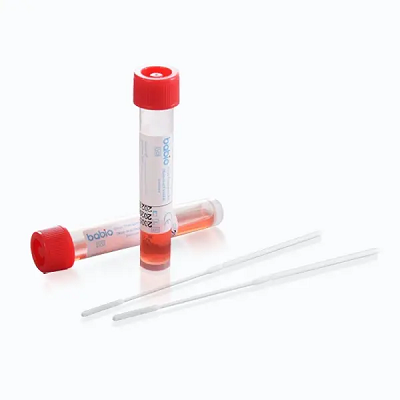
Ten kamień milowy wzmacnia światową pozycję lidera BABIO w zakresie rozwiązań do transportu próbek klinicznych. Zestaw został zaprojektowany z myślą o bezpiecznym i stabilnym pobieraniu próbek wirusów, wspierając dalsze zastosowania, takie jakRT-PCR, kultura wirusowa, Idiagnostyka molekularna. Zawiera:
-
✅ Stabilność temperatury pokojowej
-
✅ Ulepszony roztwór Hanka z antybiotykami
-
✅ Probówki stożkowe wolne od DNazy/RNazy
-
✅ Bezpieczne wymazówki flokowane z wzorem punktu przerwania
Dostępny w różnych pojemnościach (1–6 ml) i opakowaniach (20–500 probówek), zestaw idealnie nadaje się do szpitali, laboratoriów i instytucji zdrowia publicznego na całym świecie.
ZDzienna zdolność produkcyjna na poziomie 100 000 sztuk, BABIO zapewnia stałe dostawy i konkurencyjne ceny. Zaufany wStany Zjednoczone, Niemcyi nie tylko, BABIO w dalszym ciągu dostarcza innowacje i niezawodność w systemach transportu wirusów. Dowiedz się więcej na stronie https://www.babiocorp.com.
#VirusTransportKit #FDA510k #BABIO #ClinicalDiagnostics #VTM #RT-PCR #GlobalHealthcare #MedicalDevices #SpecimenCollection


